PREGUNTAS FRECUENTES IAPC
Disminución / Ausencia de reflujo. Esta técnica nos permite estar seguros de su correcta aplicación (De no hacerlo bien, tendremos reflujo) Tema que trataremos en el capítulo 8.
Reduce el tiempo de inseminación (1 minuto por cerda). Brindando mayor tiempo para otras actividades. Además, su simpleza reduce los márgenes de errores y puede ser realizado por un único operario.
Disminuye los costos de producción. Asociado a las mejoras en los índices de conversión y ganancia media diaria, entre otros.
Disminuye el N° de machos utilizados. Como consecuencia de utilizar menos espermatozoides por dosis. En el capítulo sobre dosis (Capitulo 7) discutiremos este tema.
Científicamente está comprobado que NO. Pero, si mejoramos el proceso podremos obtener mejores resultados.
En la mayor parte de Europa y EEUU está más difundida su utilización. Sin embargo, en LATAM y mercado Asiático todavía hay margen de implementación.
Debes conocer dos puntos:
1) Dinámica de apertura y cierre.
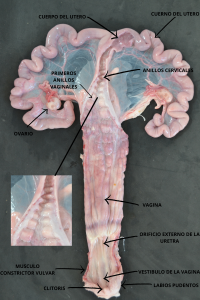
Cuando inicia el celo, el cérvix comienza con su apertura y cuando está finalizando, comienza su cierre. El momento de máxima apertura es cuando la hembra está ovulando. Queda claro entonces que no se abre y cierra como una puerta. Su apertura/cierre son paulatinos.
Por lo tanto, si intentamos atravesar el cérvix muy temprano o muy tarde respecto a su ovulación, probablemente cueste más o bien, no ingrese la sonda.
2) Estímulo es igual a contracción.
Cuando una hembra está en celo, oler el padrillo, verlo, tocar su zona lumbar o vulva para limpieza, introducir un catéter, etc. son actividades que la estimulan. Cada vez que esto suceda, el cérvix por reflejo se contraerá y será más difícil ingresar la sonda.
En términos generales, los motivos son:
-El cérvix está en estado de contracción porque la cerda recibió estímulo. Para lo cual, debe esperarse unos minutos para que se relaje
-Es una cerda primípara o nulípara y por sus características anatómicas puede demorar la relajación del cérvix.
-Estoy intentando inseminar dentro del periodo del celo de la cerda, pero muy pronto o muy tarde respecto a su ovulación.
-Definitivamente estoy intentando inseminar la cerda fuera del periodo del celo.
-Estoy inseminando de modo post-cervical pero con el padrillo en frente, lo cual provoca mayor contracción del cervix y me dificulta su ingreso.
-La cerda presenta alguna particularidad en su cervix como por ejemplo, una cicatriz que impide atravesarlo.
Enlace con dirección a “Easy Track”
No debe existir reflujo durante la inseminación. Si ocurre, estamos realizando el proceso con errores.
– Si es por vulva, la sonda NO está en el útero. Al colocarla, probablemente la sonda en vez de atravesar el Cérvix, se ha plegado o doblado y estamos dejando el semen en la vagina y por consiguiente, vemos que cae por vulva.
-Si es por el Catéter, Podríamos decir que el útero no está receptivo, la cerda está tensa o con miedo o incluso puede estar ajustando su abdomen y ejerciendo presión sobre el útero (recuerda que es un espacio muerto) lo cual provoca que el semen no ingrese de modo correcto.
Retirar la sonda a posición original. Recolocar el catéter sin estimular demasiado. Re introducir la sonda. Volver a inseminar con la misma dosis si hubo poco reflujo o con una dosis nueva si hubo demasiado reflujo.
Puede aplicarse en cualquier grupo de cerdas. Pero debemos conocer muy bien qué esperar de cada una de ellas.
Si, puede realizarse. Pero debemos conocer muy bien las diferencias existentes entre adultas y este grupo de cerdas para no cometer errores y evitar falsas expectativas.
No, lo que modificamos con esta técnica es el cambio en la metodología de entrega de semen en una cerda en celo. Su protocolo (frecuencia y cantidad de dosis) se ajusta en base a otras variables.
El número de dosis se mantiene igual o baja por la razón de que si tenemos dificultad para pasar la cánula interior, lo más recomendable es quitar el catéter y no inseminar ya que que el cérvix se está terminando de cerrar indicando que el celo ya está terminando y, por lo tanto, que la ovulación ya se ha producido.
Simple, luego de la recela (o retajeo) y con las cerdas identificadas a inseminar, esperamos a la relajación del Cérvix y procedemos a la inseminación. Luego, con el padrillo en frente podemos inseminar de modo convencional. Si es la segunda dosis, incluso podemos ingresar al galpón directamente a inseminar post-cervical sin que haya pasado el padrillo (sabiendo que aún sigue en celo).
Más info en el capítulo 6- Protocolo.
No, la dosis de post-cervical tiene menor volumen y menos espermatozoides debido a que estamos entregando el material directamente dentro del útero. Es una de las grandes ventajas de la técnica.
Nunca fracciones dosis convencionales para post-cervical al momento de inseminar. ¡Jamás podrás hacerlo correctamente!
Es un parámetro que fijará el CIA de acuerdo a su criterio de CALIDAD. En Argentina la mayoría trabaja con volúmenes de 50-60ml y 1.500 mil millones de espermatozoides.
No es necesario. Antiguamente se «calentaba» a 37 ºC para recién introducirla en la inseminación. Está comprobado que podemos retirar de la conservadora (17ºC) y llevarla a gestación para inseminar directamente sin afectar los resultados.
Una dosis que perdió la temperatura de refrigeración no puede volver a conservarse.
- No conocemos la concentración inicial (cuando las compramos en un CIA) pudiendo al fraccionarla dividirlas en concentraciones inferiores a las recomendadas
- No conocemos la concentración final a la cual quedará efectivamente cada una de las dosis.
- Chocolate en leche caliente se diluye mejor que en leche fría. De modo similar, el fraccionamiento de semen al momento de su producción brinda mejores resultados que hacerlo cuando las dosis ya fueron conservadas. Recuerda que los CIAS tienen un parámetro de calidad llamado «Cantidad uniforme de células por dosis» y deben intentar fraccionar las dosis en la misma cantidad para cada una. Cuando se encuentran un 10% fuera de la meta deben intervenir.
- Es preferible no agregar variables extras al procedimiento. Con énfasis en aquellas granjas que tienen gran cantidad de inseminaciones por semana.
- Evitar incurrir en procesos poco higiénicos
El mayor impacto se obtiene al inseminar con padrillos de mejores índices genéticos (por uso eficiente de su producción de semen). Sin embargo, a pesar del mayor costo del catéter, en términos generales es compensado con el mayor tiempo obtenido y/o diferencia económica en el valor de la dosis.
PASO 1 – “Limpiar la vulva”. Vamos a introducir un catéter dentro del útero, hacerlo sin limpieza puede provocar infecciones. Para evitarlo, asegúrate que la limpieza sea excelente.
Utiliza una toallita desinfectante no espermicida con la humedad necesaria. Comienza limpiando la vulva por fuera pero, con la segunda toallita abre los labios vulvares y limpia de adentro hacia afuera.
PASO 2 – “Introducir catéter” Rompiendo el envoltorio que lo cubre, evitando que la punta toque alguna superficie y lubricándola, abre los labios vulvares e introdúcelo al igual que en la técnica convencional.
PASO 3 – “Verificación” Siempre que estés por realizar la introducción de la sonda, previamente asegúrate que el catéter esté fijo en el fondo de la vagina. Simplemente realiza un pequeño tirón hacia atrás (acción de retirarlo) y corrobora que no “sale” fácilmente.
PASO 4 – “Introducción de sonda” Empuja suavemente “con tres dedos” hasta que haga “tope” (no avance fácilmente). Espera unos minutos para que el Cérvix relaje (C3P11) y continúa su introducción hasta el final.
PASO 5 – “Introducción de dosis”. Luego de homogenizar con movimientos suaves, introdúcela ejerciendo presión sobre la dosis con tus dedos, verificando que no haya reflujo. Ya sabes que hacer en caso contrario (C8P37)
PASO 6 – “Terminado” Puedes retirar el conjunto completo, el semen ya quedó dentro del útero.
-Fuimos demasiado bruscos o no esperamos el suficiente tiempo de relajación para introducir la sonda del catéter y provocó una laceración o herida en la mucosa durante el paso del cérvix. -Estamos intentando inseminar con el padrillo en frente y provoca cierta contracción del cérvix dificultando el paso de la sonda y ayudando a que suceda lo explicado en el punto anterior.
En términos generales, pueden producirse camadas reducidas (Ausejo, et al 2018). En aquellos casos en que el cérvix fue demasiado herido, la cicatrización posterior del mismo puede obstaculizar el canal.
Nada. Si pasa más tiempo, una hora o más, solo podremos observar que las hembras ya se encuentran todas acostadas y puede costar un poco más mantenerlas de pie para inseminarlas.
Dependerá de cada cerda en particular, para algunas el tiempo de relajación del cérvix es menor a 45 minutos. Quizás aún no se haya relajado lo suficiente el cérvix y solamente deba esperar un poco más para atravesarlo.
Hay profesionales que lo recomiendan. Podríamos suponer que, una vez entregado el semen, el estímulo del padrillo provocará por un lado la contracción del cervix y por el otro la contracción del útero que ayudará al transporte seminal. Hasta la fecha, no encontramos demasiados estudios que indiquen que hacerlo contribuirá a la mejora en los resultados. Si implica demasiados movimientos de acuerdo a la rutina de la granja y no hay mejoras observables, ¿Conviene?
Si en su experiencia observa mejoras medidas adecuadamente y notables, conviene.
Excelente detección de celo.
Semen de excelente calidad.
Mantener muy buena higiene.
Introducir la cánula con suavidad.
No estimular la cerda mientras se procede a la introducción de la cánula.
Se recomienda el uso de toallitas húmedas descartables. Ya que las mismas son además antisépticas y no espermicidas. Una mancha de chocolate en el suelo es más simple de limpiar con humedad que con un papel seco.
Siempre limpiar de arriba hacia abajo descartando luego esas toallitas. Abrir un labio de la vulva y con otra toallita limpiar con un dedo el interior de los labios vulvares.
Hay varios tipos, espiralados, multianillas y esponjas. Lubricados y sin lubricar. Con freno y sin freno. Es importante que la sonda interna tenga punta roma con doble salida y que sea un material con memoria pero flexible.
Para asegurarse el éxito es recomendable que utilices los de Genox 😉
Una vez depositado el semen dentro del útero el mismo se esparce absolutamente por todos lados. Incluso si el mismo fue direccionado hacia un cuerno del útero. No hay indicios de mejora en los resultados.
Ausejo, N. Mendoza, Dahmani, O. Mitjana, J.L. Ubeda, M.V.Falceto; 2018; Effecto of incidents associated to post-cervical artificial insemination on reproductive performance of sows; Journal of Veterinary Medicine, 2018, 21, No 2, 198–205 ISSN 1311-1477; DOI: 10.15547/bjvm.1031.
Andrés Suárez-Usbecka, Olga Mitjana, María Teresa Tejedor, C.Bonastrea, D.Moll, J.Coll, C.Ballestere, María Victoria Falceto; 2019; Post-cervical compared with cervical insemination in gilts;. Animal Reproduction Science 211, December 2019, 106207.
Maricel Compagnoni, Claudia Marcela Tittarelli, Sara Ines William.; Inseminación Artificial en la especie porcina: dosis inseminante en relación al lugar de deposición;2019; Analecta Veterinaria (CD ROM); DOI:https://doi.org/10.24215/15142590e041
Iván Hernández-Caravaca, M José Izquierdo-Rico, Carmen Matás, Juan A Carvajal, Luis Vieira, Dario Abril, Cristina Soriano-Úbeda, Francisco A García-Vázquez; 2012; Reproductive performance and backflow study in cervical and post-cervical artificial insemination in sows; Anim Reprod Sci. Affiliations expand. PMID: 23141953 DOI: 10.1016/j.anireprosci.2012.10.007. ;136(1-2):14-22. doi: 10.1016/j.anireprosci.2012.10.007. Epub 2012 Oct 24.
Fernando Cane, Norma Pereyra, Valentina Cane, Patricia, Marini-c, Juan Manuel Teijeirob-d; 2019; Mejoramiento del porcentaje de parición mediante el uso de inseminación artificial en cerdas; Rev MEx. CsArgrop. https://doi.org/10.22319/rmcp.v10i3.4772.
Nutthee Am-in, Wichai Tantasuparuk, R. Manjarin, Roy Kirkwood; 2011; Effect of site of sperm deposition on fertility when sows are inseminated with aged semen; Journal of Swine Health and Production 19(5):295-297.
E. A. Martinez1 J. M. Vazquez, J. Roca, X. Lucas, M. A. Gil, I. Parrilla, J. L. Vazquez; B N Day; 2002; Successful non-surgical deep intrauterine insemination with small numbers of spermatozoa in sows; Reproduction (2001) 122, 289–296 (Research).
E. A. Martinez, J. M. Vazquez, J. Roca, X. Lucas, M. A. Gil, I. Parrilla, J. L. Vazquez; 2002; Minimum number of spermatozoa required for normal fertility after deep intrauterine insemination in non-sedated sows; Animal Reproduction 123, 163–170 (Research).
Matthew McBride, Rocio Amezcua, Glen Cassar, Terri O’Sullivan, Robert Friendship; 2019; Combining Fixed-Time Insemination and Improved Catheter Design in an Effort to Improve Swine; Published online PMID: 31569572 PMCID: PMC6826949 DOI: 10.3390/ani9100748
P.E. Bennemann, E. Milbradt, G.N. Diehl, D. Weber, A.C.T. Schimidt, M.L. Bernardi, I. Wentz, F.P. Bortolozzo; 2004; Reproductive performance of sows submitted to intrauterine insemination at different pre-ovulatory intervals; Anim. Reprod., v.1, n.1, p.106-110, Oct./Dec. 2004 106
P F Watson, J R Behan; 2002; Intrauterine insemination of sows with reduced sperm numbers: results of a commerciall; Elsevier Theriogenology 57(6):1683-93. PMID: 12035978 DOI: 10.1016/s0093-691x(02)00648-9. Doi: 10.1016/s0093-691x(02)00648-9.
S. Dimitrov1, E. Jeliazkov1, D. Levis; 2007; Deep intrauterine and transcervical insemination of sows and gilts; Journal of Sciences, Vol. 5, No. 1, pp 40-46, 2007. Copyright © 2007 Trakia University Available online at: http://www.uni-sz.bg ISSN 1312-1723
Kelly Jaqueline WillAna Paula Gonçalves Mellagi Mari Lourdes Bernardi Fernando Pandolfo Bortolozzo Rafael da Rosa Ulguim; 2021; Perspectives of intrauterine artificial insemination applicability in gilts; ANIMAL REPRODUCTION, Cienc. Rural 51 (5) Doi: https://doi.org/10.1590/0103-8478cr20200612
Mezalira 1, D Dallanora, M l Bernardi, I Wentz, F P Bortolozzo; 2005; Influence of sperm cell dose and post-insemination backflow on reproductive performance of intrauterine inseminated sows;Reprod Domest Anim PMID: 15654993 DOI: 10.1111/j.1439-0531.2004.00524.x..
Brad A Belstra 1, Kilby L Willenburg 1, Domingo H Gómez-López 1, Robert V Knox 2, Kara R Stewart; 2020; Effects of the number of sperm and site of uterine semen deposition on conception rate and the number of embryos in weaned sows receiving a single fixed-time insemination; J Anim Sci; PMID: 32853338 PMCID: PMC7507410 DOI: 10.1093/jas/skaa260. Sep 1;98(9):skaa260. doi: 10.1093/jas/skaa260.
Éder Batalha Araújo, Eduardo Paulino da Costa, Aurea Helena Assis da Costa, Flávio Guiselli Lopes, Gustavo Guerino Macedo, Tarcízio Antônio Rêgo de Paula; 2009; Desempenho reprodutivo de matrizes suínas inseminadas pela técnica intrauterina; Breeding, Genetic and Reproduction R. Bras. Zootec. 38 (8) Doi: https://doi.org/10.1590/S1516-35982009000800009.
Langendijk P, Soede NM, Kemp B. 2005. Uterine activity, sperm transport, and the role of boar stimuli around insemination in sows. Theriogenology. 63(2):50013.
doi: 10.1016/j.theriogenology.2004.09.027
Suarez-Usbeck A, Mitjana O, Tejedor MT, Bonastre C, Moll D, Coll ´ J, Ballester C, Falceto M; 2019; Post-cervical compared with cervical insemination in gilts: reproductive variable assessments, Animal Reproduction Science , doi: https://doi.org/10.1016/j.anireprosci.2019.106207 (accesado 08/2021)
García-Vazquez, P.J. Llamas-Lopez, M.A. Jacome, L. Sarrias-Gil, O. Lopez Albors; 2019; Morphological changes in the porcine cervix: A comparison between nulliparous and multiparous sows with regard to post-cervical artificial insemination; ElSevier Inc.
DOI: 10.1016/j.theriogenology.2019.01.004
Andres Suarez-Usbeck, Olga Mitjana, Marıa Teresa Tejedor, Bonastre, D. Moll, J. Coll, Ballester, María Victoria Falceto; 2019; Post-cervical compared with cervical insemination in gilts: reproductive variable assessments. Elsevier PII: S0378-4320(19)30271-4 DOI: https://doi.org/10.1016/j.anireprosci.2019.106207
García Vázquez FA, LlamasLópez PJ, Jacome, MA, Sarrias Gil L, Albors OL; 2019; Morphological changes in the porcine cervix: A comparison between nulliparous and multiparous sows with regard to postcervical artificial insemination. Theriogenology. 127:1209. Doi: 10.1016/j.theriogenology.2019.01.004
Hernández Caravaca I, IzquierdoRico MJ, Matás C, Carvajal JA, Vieira L, Abril D, Soriano Úbeda, García–Vázquez; 2012; Reproductive performance and backflow study in cervical and postcervical artificial insemination in sows. Animal Reproduction Science. 136(12):1422. Doi: 10.1016/j.anireprosci.2012.10.007
Hernández Caravaca, Llamas López, Izquierdo Rico, Soriano Úbeda, Matás, Gardón, García Vázquez; 2017; Optimization of postcervical artificial insemination in gilts: Effect of cervical relaxation procedures and catheter type; Theriogenology. 90:14752. Doi: 10.1016/j.theriogenology.2016.11.027
Mezalira A, Dallanora D, Bernardi ML, Wentz I, Bortolozzo FP; 2005; Influence of sperm cell dose and post insemination backflow on reproductive performance of intrauterine inseminated sows; Reproduction in Domestic Animals. 40(1):15. Doi: 10.1111/j.14390531.2004.00524.x
PÁGINAS WEB CONSULTADAS:
Magapor; Recomendaciones para realizar insemianción post-cervical en cerdas nuliparas; https://www.porcicultura.com/micrositio/Magapor/Recomendaciones-para-realizar-inseminaci%C3%B3n-postcervical-en-cerdas-nul%C3%ADparas Accesado Septiembre 2021.
Francisco A Garzía Vazquez, et. al; Optimización de la inseminación post-cervical en la especie porcina: puntos críticos; https://www.3tres3.com/articulos/optimizacion-de-la-inseminacion-post-cervical-en-la-especie-porcina-p_36170/ Accesado septiembre 2021
Javier Gil Pascual, La inseminación Post-Cervical, https://www.3tres3.com/articulos/%C2%BFcomo-funciona-la-inseminacion-postcervical-en-la-cerda_45301/ Accesado Septiembre 2021
J. L. Hancock; Fertilization in pig; https://rep.bioscientifica.com/view/journals/rep/2/3/jrf_2_3_009.xml Accesado Septiembre 2021
Gil M A, Fisiología de trcato genital de la cerda y el verraco; https://www.archivo-anaporc.com/2009/02/24/fisiolog%C3%ADa-del-tracto-genital-de-la-cerda-y-el-verraco; Accesado septimebre 2021
Cambios morfológicos en el cuello uterino porcino: una comparación entre cerdas nulíparas y multíparas con respecto a la inseminación artificial poscervical: https://pubmed.ncbi.nlm.nih.gov/30685687/ Accesado Agosto 2021
Alfonso Bolarin; Impacto económico de la post-cervical; https://www.3tres3.com/articulos/impacto-economico-de-la-inseminacion-post-cervical-en-una-granja_36823/ Accesado Septiembre 2021
Francisco A. García Vazquez, et al; Avances en la inseminación artificial en cerdas nulíapras; https://www.3tres3.com/articulos/avances-en-la-inseminacion-artificial-en-cerdas-nuliparas_40187/ Accesado Septiembre 2021
Francisco A. García Vazquez, et al; Optimización de la inseminación poscervical en porcinos: puntos críticos; https://www.pig333.com/articles/optimization-of-post-cervical-insemination-in-pigs-critical-points_11045/ Accesado Septiembre 2021